|
近十几年来,越来越多的美国人意识到了养生保健的重要性,对使用保健品的热情与日俱增。这也使得我国出口美国的天然保健产品更受关注,与保健品相关的产业也得到了长足的发展。
为了促进我国保健品国际贸易的发展,帮助更多的企业了解国外保健品市场情况和准入要求,由中国医药保健品进出口商会组织业内专家编写的《出口保健品质量安全手册》,对国外市场进行了详细的介绍,其中对美国市场尤为关注,进行了较大篇幅的介绍和分析。
DSHEA促美补充剂发展
在美国,保健品被称为膳食补充剂或饮食补充剂(Dietary Supplements),其主要依据的是美国于1994年10月通过的《膳食补充剂健康与教育法案》,(Dietary Supplement Health and Education Act,简称DSHEA),该法规旨在为膳食补充剂制定新的监管框架结构。
依据DSHEA,美国于1997年对《食品、药品和化妆品法》进行了修订,为膳食补充剂的安全和标签管理创造了一个新的体制,从根本上改变了FDA监管饮食补充剂的方式。DSHEA澄清了以前膳食补充剂概念不清的属性,明确建立于归属于食品大类下的小类“膳食补充剂”,产品扩大到除维生素、矿物质、蛋白质以外的其他多种植物产品(包括植物提取物及相关产品),并允许多成分的组合膳食补充剂产品。这一条款对膳食补充剂制造业有着不可估量的重大影响。
DSHEA从成分、剂型、功效、标签等几个方面对膳食补充剂进行了规定。成分包括:维生素、矿物质、草药或其他植物、氨基酸、可以使人增加饮食摄入量的膳食成分(如酶、动物器官组织、腺体等),或上述成分的浓缩物、代谢物、结构成分、提取物,或上述成分的组合成分;明确了“不能代替传统食品使用,或不能作为一日三餐中唯一的饮食”,并可能包括一些新批准的药品、抗生素或生物制品(主要指在FDA批准该新药、新抗生素或新生物制品上市前,已作为膳食补充剂或食品在美国合法上市的那一类产品)。
自DSHEA颁布以后,美国饮食补充剂制造业蓬勃发展,消费者有了更多的选择。然而,由于法规将所有的“天然产品”一概作为食品或保健食品类管理,显然过于形式,因此也带来了一些安全问题。
不同于药品的“行规”
在美国,主要由FDA食品安全与营养中心(Center for Food Safety and Applied Nutrition,CFSAN)负责膳食补充剂市场的主要管理工作,包括检查产品标签、包装说明书及其他促销资料中的产品功能要求。而广告领域主要由美国联邦贸易委员会(Federal Trade Commission,FTC)负责检查膳食补充剂的广告宣称是否合法。此外,还有两个与膳食补充剂相关的机构:膳食补充剂办公室(ODS)和膳食补充剂标签委员会(CDSL),作为FDA膳食补充剂管理的顾问。
FDA对膳食补充剂与“食品添加剂”和“药品”在管理上的根本区别在于:后两者都必须向FDA证明产品的安全性,经FDA批准后方可上市;而膳食补充剂可以先上市,在FDA证明产品不安全时才会被勒令撤出市场。因此,保健品进入美国一般不需要经历复杂的程序,但需注意以下几个问题:
1.新膳食成分
新膳食成分,指符合DSHEA饮食成分定义、且在1994年10月15日DSHEA法规通过之前未曾在美国以膳食补充剂形式上市的饮食成分。
虽然膳食补充剂的食物成分不需要像其他新食物成分或食物成分的新功用那样进行上市前的安全性评价,但必须符合有关的安全性要求。如果膳食补充剂中含有新饮食成分,制造商必须在产品预期上市的至少75天前将安全性资料和应用方面的材料呈交FDA。FDA在收到通知后75天内回函,告知编号并归档。对于无编号的产品,FDA则通知海关扣货并拒绝进口。对于安全性资料,FDA保密90天,90天后可公诸于众,除非该信息涉及商业秘密或其他秘密商业信息。
由于FDA没有统计过在1994年10月15日DSHEA通过以前上市的补充剂品种成分,因此不存在任何权威性膳食补充剂目录。所以FDA必须依靠制造商自己确定产品是否归类“新成分”。如果不属于新成分,制造商应有资料证明其成分在1994年10月15日前就已上市。
2.一般标签规定
一种产品是否按照膳食补充剂进行管理,关键在于其标签内容是否宣称可以预防、诊断及治疗疾病,标签是否符合规定。也正因如此,DSHEA及相关法规对膳食补充剂的标签进行了详细的规定。
DSHEA要求膳食补充剂标签上必须显示一些内容:完整的组成成分数据表;厂商对各主要营养成分的建议摄入量、日摄取量;产品所含的非营养性饮食成分;所取植物部分的名称(如果有的话);制造商信息等。
此外,在标签上有产品作用说明,生产厂家或经销商须在该产品上市后10天以内通知FDA并提供相关资料,但无须预先征求FDA的同意;还要在标签上标明产品营养成分或提及产品可能与疾病和健康有关系的说明,生产厂家或经销商须至少在产品上市前120天通知FDA并须获得其批准。
3.功能声称
膳食补充剂往往具有强身保健作用,因而标签上的产品功能声明对这类产品来说极为重要。FDA对膳食补充剂标签的产品功能声明有严格的规定,其所允许的产品功能声称有3类:营养含量声称、保健声称以及改善人体功能结构声称。必须保证产品用途和功能声称以事实根据为基础、属实和不具误导成分。
其中,营养含量声称,是指描述膳食补充剂中营养物的信息。通常此类声称针对的是已有明确日摄入量规定的膳食成分,或者也可通过百分比描述或对比描述宣传其功效。这些膳食补充剂的营养物定量性指标应在第一次上市后30日内向FDA备案。
为了遏制美国市场上伪劣膳食补充剂的泛滥现象,美国FDA于2009年1月宣布有关膳食补充剂产品的新规定,要求所有在美上市销售膳食补充剂的美国或外国公司都必须在其产品外包装标识中注明产品主要成分含量,并向FDA出具有关部门的成分测定报告。这些量由制造商确定,无须美国FDA的评价和批准。
保健声称,则描述一种食物或膳食成分与健康状态或降低一种疾病风险的关系,如“钙可以降低患骨质疏松症的机率”。根据规定,膳食补充剂标签上有关营养物质与疾病或病症的保健声称必须经FDA批准。虽然DSHEA建立了对这一条款的减免,但仍必须符合有关规定,即制造商必须在产品上市前至少120天向FDA递交:标签保健声称的通知;具有权威性的声明,以认同该项声称确切属实;科技文献资料依据。
结构/功能声称,是描述营养物质与营养不良疾病有关联,例如“人体缺少维生素C会导致坏血病”,但标签上要求披露这种疾病在美国的普遍程度;还可以描述所含营养成分如何改善或维持人体结构功能,或描述摄入该营养成分对提高人体健康的一般好处。
与“保健声称”不同,法规并不要求此类声称的上市前FDA审批,而由生产企业负责该声称的真实性和准确性。但如果产品标签含有此类声称,则须同时在标签显著位置用粗体标注“该声称未经FDA审评,该产品不用于诊断、治疗或预防疾病”。此外,制造商必须在产品首次上市后的30天内,向FDA营养产品办公室提交一份书面通知。
需要注意的是,DSHEA严禁膳食补充剂在标签和广告上声称有药物作用,即不允许声称产品可以治疗、诊断或预防某种疾病等药物作用,诸如“银杏可以防治老年痴呆症”之类。因为这种文字说明是未经过FDA批准的,因此将被作为非法药品论处。
4.膳食补充剂cGMP
2007年,FDA发布了膳食补充剂cGMP最终法规。按照该法规,企业必须对其产品的特性、纯度、浓度和成分组成做出评价。如果膳食补充剂含有污染物或未含有所描述的膳食成分,FDA将认定这些产品为掺杂或使假。
为了减少对小型企业生产的食品补充剂的影响,该法规要求所有企业最终要在2010年6月前符合规定。该法规对美国补充剂市场具有促进作用,同时对我国出口美国的补充剂原料产生了一定影响,主要体现在产品质检要求上。因此,我国保健品出口企业应予以重视,并作出相应调整。
另外,需要注意的是,尽管DSHEA并未要求膳食补充剂生产企业向FDA登记企业相关信息,但根据2002年美国国会通过的《公共卫生安全与生物恐怖防范应对法案》规定,所有膳食补充剂企业必须在开始从事生产、销售前向FDA登记生产企业信息。
进军美补充剂市场
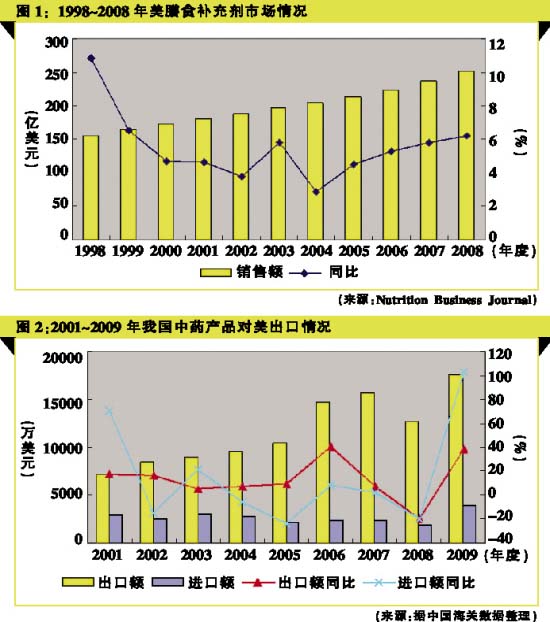
美国是全球最大的健康产品(包括膳食补充剂、天然&有机食品、功能性食品、个人&家庭护理产品)市场,其2008年的市场规模已达1040亿美元,同比增长8.8%,其中,膳食补充剂市场为251.8亿美元,同比增长6.2%,占比达25.3%。由于DSHEA设定的准入门槛较低,所以我国中药产品出口美国基本上都是按照膳食补充剂进行管理,并且多是作为膳食补充剂的原料。据中国海关数据统计,截至2009年,我国出口美国的中药类产品已达1.76亿美元,同比增长38.6%。
《出口保健品质量安全手册》指出,在美国补充剂市场中,草药类膳食补充剂占比较大,是我国中药产品或天然产品的重要目标市场。据Nutrition Business Journal统计,2009年美国草药/植物膳食补充剂产品销售额高达50.3亿美元,同比增长4.8%,约占美国膳食补充剂20%的市场份额。我国许多中药材、植物提取物、天然保健品等都是重要的补充剂原料。因此,积极进军美国补充剂市场意义重大。
基于中药产品的特殊性,在具体操作中必须注意以下几个问题:
1.选择药性平和的中药品种
膳食补充剂在美国属于食品范畴,因此不宜选择那些药性强烈或副作用较大的中药品种在美国上市。
2.选择非毒性药材或不属于濒危药材的品种
从安全性角度考虑,附子、斑蝥、雄黄、马钱子等毒性较大,不宜作为膳食补充剂销售;而濒危药材,则需要到双方国家濒危物种进出口管理机构就进出口事宜进行审批,手续相对较为复杂。
3.剂型上应选择口服给药途径
我国的中药产品存在片剂、胶囊剂、颗粒剂、注射剂等多种剂型,但膳食补充剂只允许存在口服给药途径,因此注射剂、栓剂、滴眼剂等非口服给药途径的中药品种就不宜按膳食补充剂上市。
4.注意重金属含量、农残问题
我国中药材产品最突出的问题是农药残留问题,对此应特别注意。另外,我国生产的一些中成药,特别是一些传统名牌中成药,如安宫牛黄丸、六神丸、紫金丹等,含有一些矿物质药材,产品中的砷、铅等重金属含量往往会超过FDA的限定量。因此,对于复方制剂,如果组方中使用一些矿物质药材,应注意重金属含量超标问题,否则产品将无法按膳食补充剂进入美国市场。
5.注意产品标签内容问题
膳食补充剂上市前无须经过FDA审批,其安全性和功效声明完全由生产企业负责,因此应特别注意膳食补充剂的标签内容。此外,膳食补充剂标签也是FDA日常监督检查的最重要内容,生产企业必须予以高度重视。
《出口保健品质量安全手册》指出,美国保健品市场准入门槛低,市场空间大,是我国保健品企业较为理想的出口目标市场。同时,由于作为膳食补充剂使用的历史,可以在产品进行植物药申请审批时作为重要参考,所以许多中药企业也会首选将产品在美国作为膳食补充剂上市销售。整体看来,美国仍是我国保健品出口的重要市场,预期其市场容量将保持稳定增长。
|